劃痕實(shí)驗(yàn)/細(xì)胞遷移可以使用不同的方法在細(xì)胞單層創(chuàng)建間隙(稱(chēng)為“劃痕”):
插件:在細(xì)胞接種前通過(guò)將插件/模具放置在培養(yǎng)表面,來(lái)形成無(wú)殘留的空白區(qū)域/劃痕���;
刮擦:通過(guò)刮擦表面來(lái)制造人工“劃痕“機(jī)械去除細(xì)胞(劃痕分析)
阻抗:通過(guò)在指定區(qū)域施加電壓來(lái)去除細(xì)胞而創(chuàng)建間隙
有關(guān)如何創(chuàng)建間隙的更多詳細(xì)信息和方法�����,可查看此評(píng)論:
W.J. Ashby, A. Zijlstra. Established and novel methods of interrogating two-dimensional cell migration. Integr Biol 2012, 10.1039/c2ib20154b
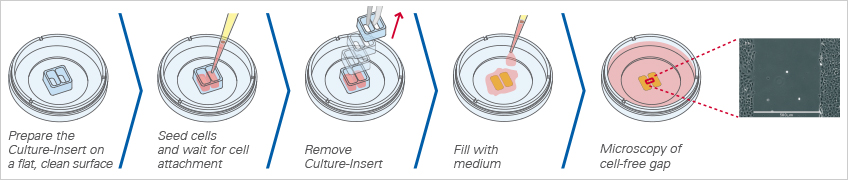
使用ibidi劃痕插件創(chuàng)建間隙
ibidi提供三種不同規(guī)格的劃痕插件用于間隙的創(chuàng)建:ibidi有2孔��、3孔和4孔插件(也有預(yù)置了2孔���、3孔和4孔插件的培養(yǎng)皿)。由于特殊的底部(靜電黏附底部)設(shè)計(jì)�����,插件(生物相容硅膠材料)可粘附在培養(yǎng)器皿的表面。移除插件后�,可形成無(wú)細(xì)胞殘留的空白間隙。此種方法使得在沒(méi)有任何細(xì)胞殘留的情況下�,可重復(fù)地產(chǎn)生高度限定的空白間隙。
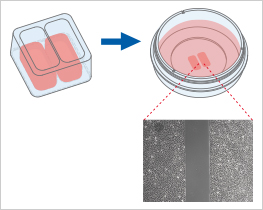
當(dāng)放置在平滑�、干燥的表面上時(shí),Culture-Insert 2 Well提供兩個(gè)用于培養(yǎng)細(xì)胞的儲(chǔ)液池�,兩個(gè)儲(chǔ)液池由500μm厚的壁隔開(kāi)。將細(xì)胞接種到儲(chǔ)液池中并培養(yǎng)直至細(xì)胞附著并形成單層�,從表面移除硅膠插件后會(huì)產(chǎn)生兩個(gè)被插件中間壁隔開(kāi)的精確定義的寬度完全相同的細(xì)胞區(qū)塊。現(xiàn)在可以通過(guò)使用活細(xì)胞成像或在不同時(shí)間點(diǎn)拍攝照片來(lái)監(jiān)測(cè)細(xì)胞遷移���。
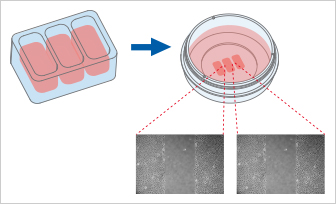
Culture -Insert 3 Well提供三個(gè)細(xì)胞培養(yǎng)池?���?蓜?chuàng)建兩個(gè)各500 µm的無(wú)細(xì)胞間隙,因此適合分析兩個(gè)技術(shù)重復(fù)或不同細(xì)胞類(lèi)型的遷移�����。
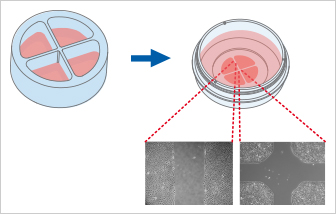
Culture -Insert 4 Well提供四個(gè)細(xì)胞培養(yǎng)池�����。除了四個(gè)500 µm無(wú)細(xì)胞間隙外,還可產(chǎn)生一個(gè)1mm的中心間隙��。Culture-Insert 4 Well可最多觀察四個(gè)技術(shù)重復(fù)或不同細(xì)胞類(lèi)型的遷移�����。
使用ibidi Culture-Insert 4 Well進(jìn)行傷口愈合和遷移測(cè)定
ibidi 3孔/4孔兩者都可以在藥物治療或基因沉默/過(guò)度表達(dá)(例如�,通過(guò) CRISPR/Cas9、siRNA�����、mRNA)后進(jìn)行細(xì)胞遷移分析�����。重要的是�����,未經(jīng)處理的對(duì)照細(xì)胞可以在同一容器中接種和分析�,共享相同的培養(yǎng)基。
與其他間隙產(chǎn)生技術(shù)不同��,ibidi劃痕插件系列產(chǎn)品還適用于2D侵襲實(shí)驗(yàn)和同時(shí)使用兩種���、三種甚至四種細(xì)胞類(lèi)型或處理的共培養(yǎng)實(shí)驗(yàn)��。
通過(guò)刮擦創(chuàng)造間隙
進(jìn)行劃痕測(cè)定時(shí)���,細(xì)胞會(huì)生長(zhǎng)直至形成單層�����。然后����,用移液管尖端或針頭手動(dòng)刮擦細(xì)胞表面以產(chǎn)生傷口����。通過(guò)在不同時(shí)間點(diǎn)拍攝照片或活細(xì)胞成像來(lái)監(jiān)測(cè)傷口閉合和細(xì)胞遷移。
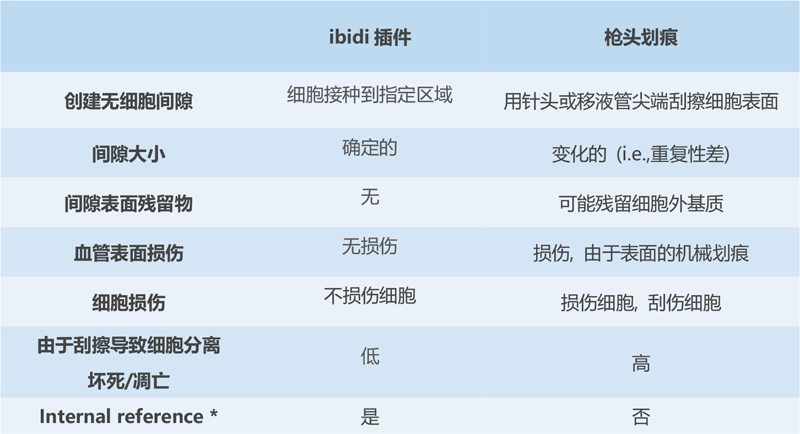
關(guān)于再現(xiàn)性����,該方法有一定的缺點(diǎn):
間隙的寬度在很大程度上取決于施加到移液器尖端的壓力和其尺寸����。
刮擦?xí)圆豢蓮?fù)制的方式去除表面涂層。這改變了細(xì)胞在該區(qū)域的粘附和遷移�����。
去除的細(xì)胞以不可重現(xiàn)的方式在劃痕邊緣形成活細(xì)胞和死細(xì)胞團(tuán)?;罴?xì)胞的擴(kuò)散會(huì)覆蓋遷移的速度。
乍一看����,槍刮和放置插件的方法似乎是兩種非常相似的創(chuàng)建無(wú)細(xì)胞間隙的方法。然而�,仔細(xì)觀察,這兩種方法可能在重要檢測(cè)結(jié)果方面的影響存在差異:
與槍頭劃痕檢測(cè)相比�����,ibidi劃痕插件可提供更高的重現(xiàn)性
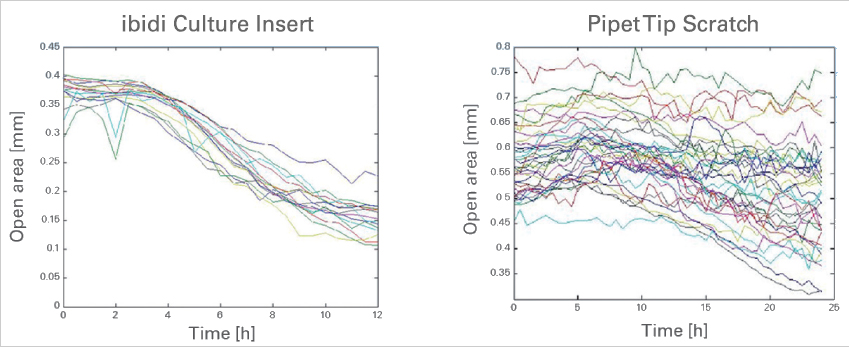
細(xì)胞遷移導(dǎo)致開(kāi)放區(qū)域隨時(shí)間變化�。使用ibidi Culture-Insert 2 well(左)和使用移液器吸頭刮擦(右)產(chǎn)生間隙的對(duì)比。數(shù)據(jù)來(lái)源:德國(guó)弗萊堡大學(xué)的M. Börries���。
使用阻抗的劃痕實(shí)驗(yàn)
ECIS傷口愈合實(shí)驗(yàn)取代了傳統(tǒng)的劃痕實(shí)驗(yàn)��。ECIS System不是用移液管尖端機(jī)械地破壞細(xì)胞層���,然后用顯微鏡跟蹤細(xì)胞的遷移,而是使用電信號(hào)對(duì)傷口進(jìn)行監(jiān)測(cè)�,然后監(jiān)測(cè)愈合過(guò)程�����?;谧杩沟膫谟蠈?shí)驗(yàn)的優(yōu)點(diǎn)包括:
•可同時(shí)進(jìn)行多達(dá)96次傷口愈合實(shí)驗(yàn)
•直接推導(dǎo)時(shí)間常數(shù)和傷口愈合速度
•經(jīng)濟(jì)高效的篩選應(yīng)用��,從低通量到高通量
電擊傷前(左)和電擊傷后(右)的細(xì)胞層�。圓圈標(biāo)記電極區(qū)域,此處細(xì)胞暴露在電中
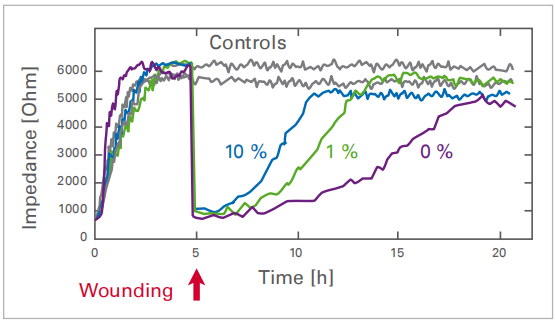
在與250μm電極接觸的一小群細(xì)胞上進(jìn)行點(diǎn)擊傷�����,從而產(chǎn)生明確的傷口����。損傷區(qū)域內(nèi)的細(xì)胞密度由阻抗反映,由ECIS系統(tǒng)連續(xù)測(cè)量�。受傷后,電極周?chē)慕】导?xì)胞立即遷移并取代電極上的死細(xì)胞�����,導(dǎo)致測(cè)量阻抗值的變化�����。根據(jù)細(xì)胞培養(yǎng)基中胎牛血清(FCS)的濃度��,在10���、13或20小時(shí)后再次達(dá)到原始細(xì)胞密度���。
對(duì)與250µm電極接觸的少量細(xì)胞進(jìn)行電損傷,從而形成明確的傷口���。受傷區(qū)域內(nèi)的細(xì)胞密度由阻抗反映���,該阻抗由ECIS系統(tǒng)連續(xù)測(cè)量。受傷后�����,電極周?chē)慕】导?xì)胞立即遷移并替換電極上的死細(xì)胞����,導(dǎo)致測(cè)量阻抗值發(fā)生變化。根據(jù)細(xì)胞培養(yǎng)基中胎牛血清(FCS)的濃度�,在10、13或20小時(shí)后再次達(dá)到原始細(xì)胞密度。
在細(xì)胞培養(yǎng)基中使用不同濃度(0%�、1%和10%)的FCS對(duì)時(shí)間依賴(lài)性傷口閉合進(jìn)行基于阻抗的分析
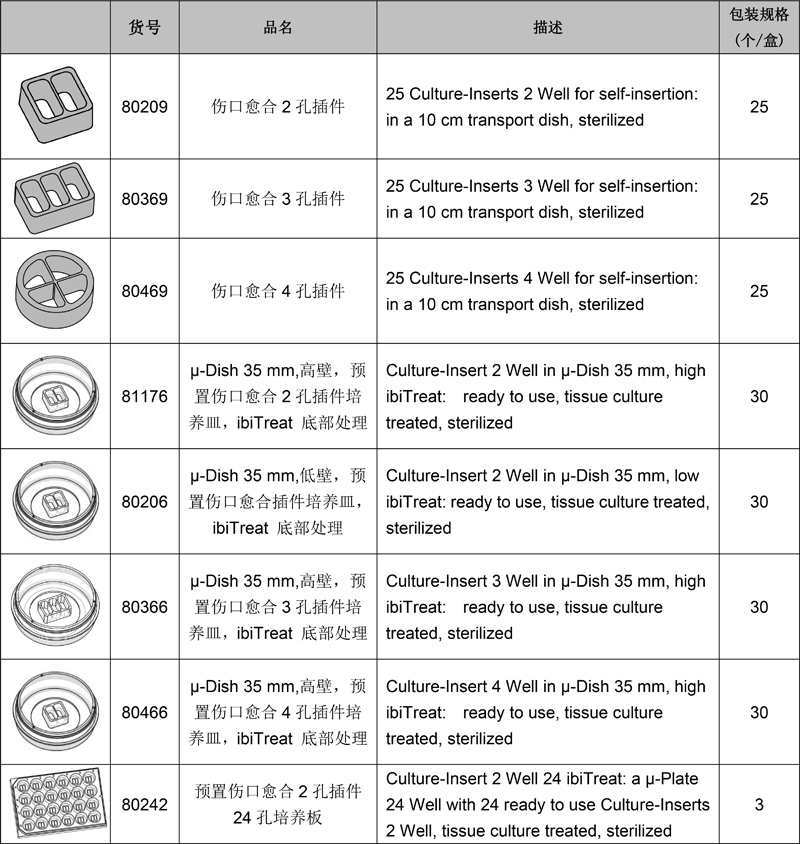
訂購(gòu)信息




 滬公網(wǎng)安備31011202005471
滬公網(wǎng)安備31011202005471