細(xì)胞剪切力實(shí)驗(yàn)--FOXC2和流體剪切力在后天淋巴管系統(tǒng)形成中的重要作用
生物體內(nèi)存在的機(jī)械力���,比如流體剪切力對內(nèi)皮細(xì)胞有著非常多的影響���。在血管中�����,不規(guī)則的亂流通常和血管的疾?���。ū热?���,動脈粥樣硬化)是相關(guān)的,并且能直接影響內(nèi)皮細(xì)胞的分化和凋亡�。因此,2015年����,瑞士的一個研究小組在淋巴管中研究不規(guī)則的剪切力的作用中發(fā)現(xiàn),不規(guī)則的剪切力和轉(zhuǎn)錄因子FOXC2共同在在淋巴管形成中有著非常關(guān)鍵的作用�����。在體外培養(yǎng)的淋巴管內(nèi)皮細(xì)胞中,FOXC2受到振蕩剪切力的刺激會高表達(dá)�����,并且增強(qiáng)細(xì)胞間的聯(lián)系�����,降低細(xì)胞的增殖率���;而FOXC2的失活會使細(xì)胞對不規(guī)則的剪切力敏感���,使細(xì)胞連接分解并且促進(jìn)細(xì)胞增值。文中��,研究人員選擇4dyn/cm2每4秒變換流向的振蕩流(OSS��,oscillatory shear stress)來模擬體內(nèi)不規(guī)則的亂流�。
FOXC2 and fluid shear stress stabilize postnatal lymphatic vasculature
A. Sabine, E. Bovay, C. S. Demir, W. Kimura, M. Jaquet, Y. Agalarov, N. Zangger, J. P. Scallan, W. Graber, E. Gulpinar, B. R. Kwak, T. Mäkinen, I. Martinez-Corral, S. Ortega, M. Delorenzi, F. Kiefer, M. J. Davis, V. Djonov, N. Miura and T. V. Petrova
The Journal of Clinical Investigation, 2015, 10.1172/JCI80454
一�、實(shí)驗(yàn)準(zhǔn)備實(shí)驗(yàn)材料及設(shè)備
1)細(xì)胞: lymphatic endothelial cells (LECs)
2)抗體:FOXC2 (大鼠抗人/小鼠,由Dr.N.Miura贈送���,Miura et al, 1997, Genomics)
VE-cadherin (山羊抗人/小鼠�����,R&D(#AF1002))
Ki67 (兔抗人/小鼠���,Abcam(#ab15580)
二抗 (Alexa 488-conjugated�,Alexa 555-conjugate��,Alexa 647-conjugated�����, Life Technologies)
3)培養(yǎng)耗材:ibidi單通道載玻片μ-Slide I0.8 Luer (ibidi�,Germany,80196)
灌流管�����,15cm�,1.6mm直徑(ibidi,Germany�����,10962)
封口夾
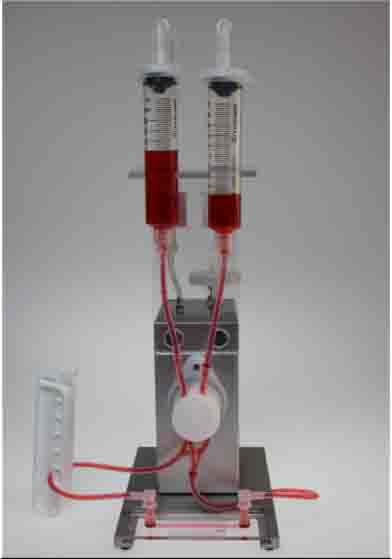
4)儀器設(shè)備:ibidi流體剪切力系統(tǒng),含空氣泵(ibidi���,Germany��,10905)和流體單元(ibidi��,Germany����,10903)
二�����、實(shí)驗(yàn)方法
在實(shí)驗(yàn)開始前一天�,請將所有需要使用的試劑,培養(yǎng)基�,通道載玻片,灌流管都在37℃的二氧化碳培養(yǎng)箱中放置過夜�,排除由于溫度差產(chǎn)生的微量氣泡。
按照下面流程鋪細(xì)胞:
1)將LECs細(xì)胞懸液加入通道載玻片中��,注意�,將移液器頭插入注液孔中再加入細(xì)胞懸液���,可以輕微傾斜通道載玻片幫助細(xì)胞懸液充滿整個通道(圖一)���。
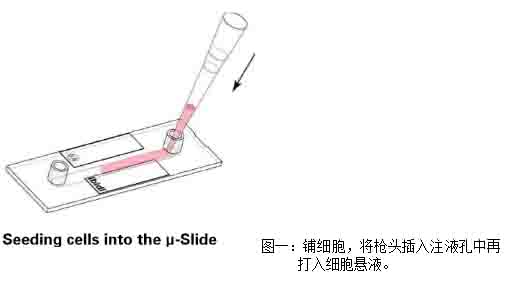
2)蓋上注液孔蓋����,將通道載玻片放入細(xì)胞培養(yǎng)箱中培養(yǎng)半小時���,等待細(xì)胞貼壁����。細(xì)胞貼壁后���,拿出通道載玻片�,在每個注液孔中分別加入60μl培養(yǎng)基���,注意�,槍頭要懸在孔上方滴入培養(yǎng)基(圖二)
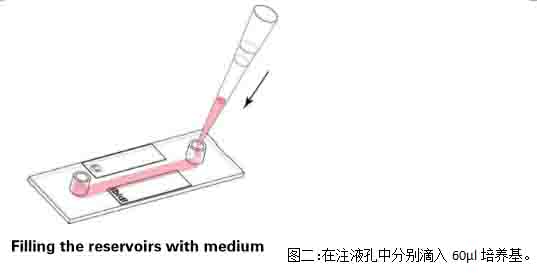
3)將通道載玻片再放入二氧化碳培養(yǎng)箱進(jìn)行培養(yǎng)24小時左右��,等到細(xì)胞剛剛長滿為單細(xì)胞層���,即可開始實(shí)驗(yàn)���。注意����,要使用單層細(xì)胞進(jìn)行剪切力實(shí)驗(yàn)�,使每個細(xì)胞均受到均勻的剪切力。
4)靜置條件下細(xì)胞培養(yǎng)�����。在通道載玻片中靜置培養(yǎng)的細(xì)胞可以作為流體剪切力條件下培養(yǎng)的細(xì)胞對照����。待流體實(shí)驗(yàn)開始的同時,將靜置細(xì)胞培養(yǎng)的對照組放入二氧化碳培養(yǎng)箱中進(jìn)行2天的培養(yǎng)�����。注意���,培養(yǎng)過程中每天都要更換培養(yǎng)基����。
二)搭建流體系統(tǒng)
1)將灌流管按照說明放在置在流體單元上�。在灌流管的儲液管中加入12ml培養(yǎng)基�����。這時不需要連接通道載玻片。實(shí)驗(yàn)前需要去除整個灌流管中的氣泡��,存留在灌流系統(tǒng)的氣泡會影響剪切力的大小����,有時還會使灌流系統(tǒng)中的液體流動停滯。打開ibidi泵控制系統(tǒng)�,在任務(wù)欄中找到“Remove air bubbles”,ibidi流體剪切力系統(tǒng)將自動運(yùn)行下面任務(wù)��,用于去除氣泡���。(表一)

2)連接通道載玻片���。去除氣泡后,就可以將之前準(zhǔn)備好的含貼壁細(xì)胞的通道載玻片與灌流管相連��。將搭載灌流管的流體單元從流體剪切力系統(tǒng)中取下���,放到超凈臺中���。將通道載玻片的注液孔用培養(yǎng)基裝至過滿狀態(tài)()�。之后就按照下面的流程圖連接通道載玻片(圖四)�。
圖四:a)封口夾輕輕將灌流管的硅膠管夾住�。b)將其中一個魯爾接頭從中間的鏈接管中拔出。c-j)按圖示���,將魯爾接頭與通道載玻片的注液孔相連,注意不能產(chǎn)生氣泡��,會有部分培養(yǎng)基溢出�����。k)連接好后����,將封口夾移除,用無塵紙將溢出的培養(yǎng)基擦除�。l)全部連接好后,用顯微鏡觀測一下通道內(nèi)的細(xì)胞狀態(tài)��。
3)檢查灌流系統(tǒng)是否密封��、是否將灌流管插入了正確的閥門����。將封口夾夾住其中一根硅膠管�����,如果兩邊的灌流儲液管液面不會下降或者上升�����,那么��,整個系統(tǒng)就是密封的�,并且是正確安裝的(圖五)。
圖五����。
三)振蕩剪切力刺激�,免疫熒光染色
1) 以4 dynes/cm2����;0.25 Hz(每4秒變換一次方向)刺激LECs細(xì)胞���,進(jìn)行48小時的培養(yǎng)�。靜置對照是直接將鋪有LECs的通道載玻片直接放在培養(yǎng)箱中培養(yǎng)48小時�,每天換一次液。
2) Ibidi通道載玻片具有非常理想的顯微成像效果��,可以直接在通道內(nèi)對處理的細(xì)胞和對照細(xì)胞進(jìn)行免疫熒光染色�,并且成像。實(shí)驗(yàn)結(jié)束后��,輕輕吸出培養(yǎng)基,PBS清洗�����。
3) 每通道以200μl的4%的多聚甲醛固定10分鐘����,用PBS清洗�����。
4) 每通道加入200μl的0.1% Triton® X-100通透3-5分鐘�����,用PBS清洗��。
5) 每通道加入200μl的1%BSA封閉20分鐘���,用PBS清洗后�����,直接吸出所有液體���。
6) 在通道未干之前加入一抗����,二抗����,進(jìn)行常規(guī)的免疫熒光操作�。
7) 加入封片液,鏡檢觀測�。
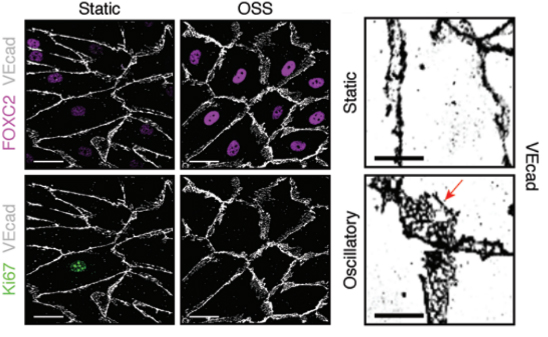
在振蕩剪切力的刺激下,研究人員檢測了FOXC2和細(xì)胞增殖生物標(biāo)記物Ki67的表達(dá)情況��。從圖上可見��,在OSS的刺激下�����,FOXC2有非常顯著的表達(dá)(粉色)而��,代表細(xì)胞增殖的Ki67的表達(dá)則顯著下降����。與此同時針對VE-cadherin細(xì)胞聯(lián)合的染色表明���,在有OSS刺激的情況下�����,VE-cadherin細(xì)胞聯(lián)合的面積明顯增大(右圖)���。





 滬公網(wǎng)安備31011202005471
滬公網(wǎng)安備31011202005471